Die MDR hat vollständige Gültigkeit erhalten - wir geben einen Überblick
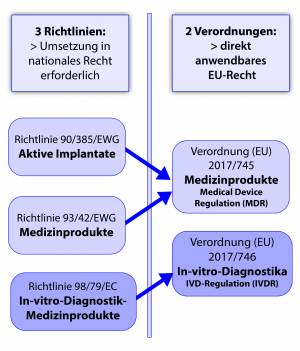 Durch die Umstellung auf die neue MDR/IVDR verschmelzen 3 Richtlinien zu zwei Verordnungen. Diese Verordnungen wirken als direkt anwendbares EU-Recht. Die MDR ist seit 26.05.21 bereits gültig und der Geltungsbeginn der IVDR für den 26.05.2022 festgelegt.
Durch die Umstellung auf die neue MDR/IVDR verschmelzen 3 Richtlinien zu zwei Verordnungen. Diese Verordnungen wirken als direkt anwendbares EU-Recht. Die MDR ist seit 26.05.21 bereits gültig und der Geltungsbeginn der IVDR für den 26.05.2022 festgelegt.
Was ist neu?
Es werden wesentliche Schlüsselelemente gestärkt und eine bessere Transparenz und Rückverfolgbarkeit gewährleistet:
1) Erhebliche Stärkung von Schlüsselelemente
- Beaufsichtigung der benannten Stellen
- Risikoklassifizierung
- Konformitätsbewertungsverfahren
- Klinischer Bewertung
- Vigilianz und Marktüberwachung
2) Gewährleistung von Transparenz und Rückverfolgbarkeit in Bezug auf Medizinprodukte
- Einmalige Produkterkennung (UDI-Unique Device Identification)
- Einmalige Registrierungsnummer (SRN – Single Registration Number)
Im Detail beinhaltet die MDR folgende Anforderungen:
- Der Anwendungsbereich hat sich deutlich vergrößert und umfasst auch Produkte zur Reinigung, Sterilisation oder Desinfektion anderer Medizinprodukte und spezielle Produkte ohne medizinischen Zweck
- Der Sicherheitsaspekt orientiert sich am gesamten Produktlebenszyklus und wird durch klinische Daten verdeutlicht
- Es werden höhere Anforderungen an benannte Stellen geltend
- Es wird ein unabhängiges Expertengremium bei der klinischen Bewertung von Hochrisiko-Produkten eingeführt
- Ein System für bessere Marktüberwachung und Rückverfolgung wurde eingeführt (UDI, EUDAMED)
- Für Hersteller ist eine Eingabe von Daten bei EUDAMED erforderlich
Anforderungen an Hersteller
Die MDR verpflichtet Hersteller in Artikel 10:
- zu einem Risikomanagementsystem
- zu einem Qualitätsmanagementsystem
- zu einer klinische Bewertung
- zu einer technische Dokumentation
- sowie ein Konformitätsbewertungsverfahren anzuwenden
Der Hersteller muss für das Inverkehrbringen und die Inbetriebnahme seiner Produkte gewährleisten, dass diese gemäß den Anforderungen der europäischen Verordnung ausgelegt und hergestellt sind. 1
Hinsichtlich der Forderung eines QM Systems wird in Artikel 10 MDR folgendes festgehalten:
„Die Hersteller von Produkten, bei denen es sich nicht um Prüfprodukte handelt, müssen ein Qualitätsmanagementsystem einrichten, dokumentieren, anwenden, aufrechterhalten, ständig aktualisieren und kontinuierlich verbessern, da die Einhaltung dieser Verordnung auf die wirksamste Weise sowie einer der Risikoklasse und der Art des Produkts angemessenen Weise gewährleistet.“
Zusammenhang MDR & Harmonisierte Normen
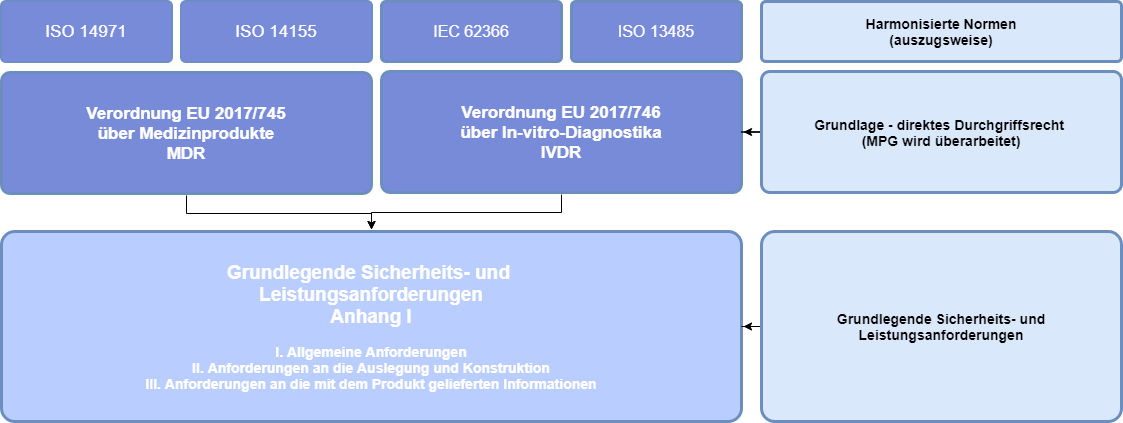
Zentrales Element des New Approach im Rahmen der Binnenmarktregelungen sind die in Anhang I (MDR) dargelegten „Grundlegende Sicherheits- und Leistungsanforderungen“ (in der MDD noch als Grundlegende Anforderungen bezeichnet). Medizinprodukte müssen die unter Berücksichtigung ihrer Zweckbestimmung für sie anwendbaren grundlegenden Anforderungen erfüllen, damit sie in der EU in Verkehr gebracht/ in Betrieb genommen werden können1 (siehe Abbildung unten):
- Kap. 1 Allgemeine Anforderungen
- Kap. 2 Anforderungen an Auslegung und Herstellung
- Kap. 3 Anforderungen an die mit dem Produkt gelieferten Informationen (Kennzeichnung, Gebrauchsanweisung, Verpackung)
Für den Nachweis der Grundlegenden Sicherheits- und Leistungsanforderungen (GSLA) müssen die Hersteller, die angewendeten harmonisierten Normen in der GSLA referenzieren, um somit die Konformität des Produktes darzulegen. Sehr wesentliche Normen sind hierbei unter anderem ISO 14971 (Risikomanagement), ISO 14155 (Gute klinische Praxis), IEC 62366 (Gebrauchstauglichkeit) und die ISO 13485 (Qualitätsmanagement).
Hilfestellung finden Hersteller in folgenden Dokumenten oder auf folgenden Websiten:
- MDR - Link zur MDR
- IVDR - Link zur IVDR
- EUDAMED - EUDAMED
- GS1 - GS1
- IMDRF - IMDRF
- MEDDEV - MEDDEV Guidance
- MDCG Dokumente -MDCG
1 Buch: Medizinprodukte und IVD - Fit für Europa -Medizinprodukte und IVD - Fit für Europa