IVDR - Geltungsbeginn
Durch die Umstellung von der IVDD zur IVDR werden aus 48 Seiten insgesamt 157 Seiten, dies bringt strengere regulatorische Vorschriften mit sich. Hersteller dürfen nicht vergessen, zeitgerecht eine Rezertifizierung ihrer Produkte vorzunehmen, auch wenn der Geltungsbeginn noch in der Ferne zu liegen scheint. Wie auch bei der MDR sollten die Hersteller die Umstellung nicht unterschätzen und als bald als möglich mit dem normkonformen Aufbau starten.
Ziel der neuen Verordnung ist die Stärkung von Schlüsselelemente des derzeitigen Regulierungskonzepts. Neu hinzu kommt die Einführung von Bestimmungen zur Gewährleistung von Transparenz und Rückverfolgbarkeit hinsichtlich einmaliger Produktkennung und der einmaligen Registrierungsnummer.
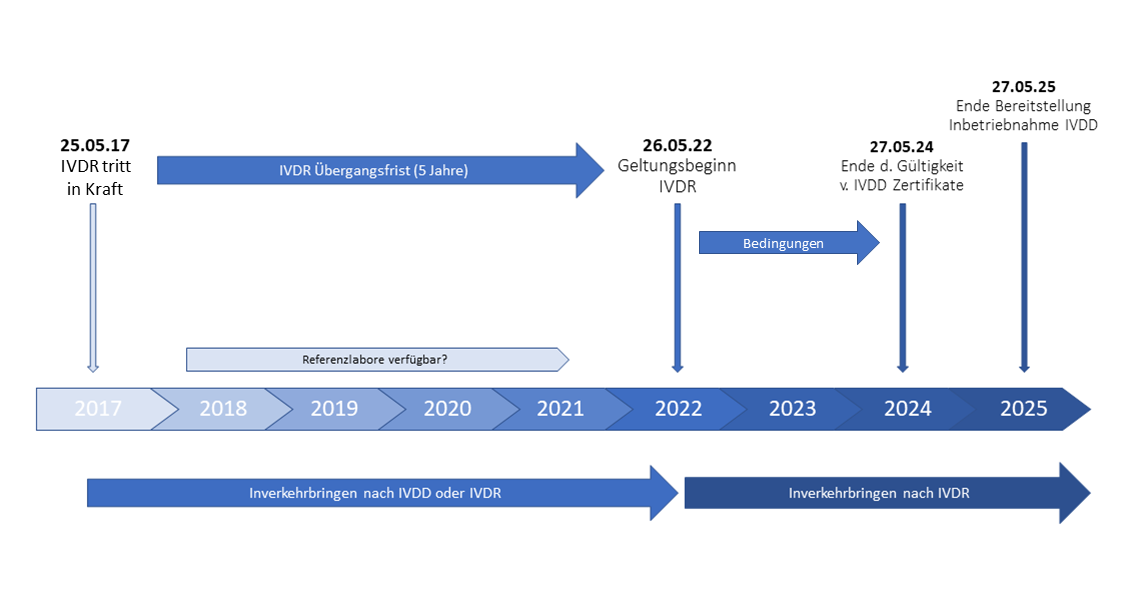
Am 25.05.17 ist die IVDR in Kraft getreten, es besteht eine Übergangsfrist von 5 Jahren bis zum 26.05.22. Ab diesem Zeitpunkt ist der Geltungsbeginn definiert. Bis dahin müssen auch noch Referenzlabore zur Verfügung gestellt werden (derzeit noch nicht erfolgt). Die benannten Stellen dürfen bis zum 26.05.22 noch Zertifikate nach IVDD ausstellen, diese sind dann längstens bis zum 27.05.24 gültig.
Die Erstinbetriebnahme von In vitro Diagnostik Produkte ist bis zum 27.05.25 gestattet. Danach müssen alle IVD Produkte nach der neuen IVD-Verordnung ausgerichtet sein. (Bestehende, bereits installierte und in Betrieb genommene IVDs dürfen weiterhin betrieben werden)
Produkte mit gültiger Zertifizierung unter IVDD dürfen nach dem 26. Mai 2022 nur in Verkehr gebracht oder erstmalig in Betrieb genommen werden, wenn folgende Punkte kumulativ gegeben sind:
- die IVDD Anforderungen müssen erfüllt sein
- es dürfen keine wesentlichen Änderungen am Produkt erfolgen
- eine Überwachung durch die benannte Stelle, die das Zertifikat unter IVDD ausgestellt hat, muss erfolgen
- folgende Anforderungen der IVDR müssen ab 26. Mai 2022 erfüllt werden:
- Registrierung Wirtschaftsakteure und Produkte
- Überwachung nach Inverkehrbringung (PMS)
- Vigilanz
Während der Übergangsfrist müssen alle CE gekennzeichneten Produkte nach IVD-Verordnung neubewertet werden.
Essenzielle Änderungen durch IVDR sind:
- ein neues Klassifizierungssystem (viele sog. Other Devices werden zukünftig in eine Klasse kommen, die eine Prüfung durch ein benannte Stelle notwendig macht!)
- Erweiterung des Geltungsbereichs und neue Wirtschaftsakteure
- Striktere Anforderungen an die Wirtschaftsakteure
- Strengere Überwachung - stärkere Mitwirkung der benannten Stellen
- Strengere Anforderungen an Transparenz und Rückverfolgbarkeit
- Strengere Richtlinien zur Technischen Dokumentation/klinischen Nachweis
- Strengere Richtlinien für Überwachung nach dem Inverkehrbringen
RnB-Consulting unterstützt Sie im Rahmen der Implementierung der europäischen Verordnungen für Medizinprodukte und In vitro Diagnostika (MDR und IVDR) und steht dabei mit erfahrenen Experten zur Seite.
Quelle: TÜV SÜD - modulare Weiterbildung - INHALTE UND UMSETZUNG DER NEUEN EUROPÄISCHEN IVD-VERORDNUNG