Praxisbeispiel - FDA Approval für AI gestützte Diagnosesoftware
Am 11. April 2018 erhielt das diagnostische Medizinprodukt IDX-DR (IDx LLC, Iowa City,IA, USA) von der FDA die Freigabe für den US-Markt. Dies ist insbesonders interessant, da dieses Medizinprodukt als zentrales Element einen Algorithmus bereitstellt, der adaptiv gestaltet ist und auf Konzepten von künstlicher Intelligenz beruht. Diese Blog-Serie soll nun die unterschiedlichen Aspekte dieses Zulassungsverfahrens diskutieren – basierend auf öffentlich zugänglichen Informationen und Datenbanken. In diesem Zusammenhang werden wir beispielsweise Themen wie den De Novo Zulassungsprozess, Anforderungen an den Software-Lebenszyklus und Cybersecurity sowie die Strategie der klinischen Validierung und Bewertung diskutieren. Wir hoffen dadurch, Herstellern von ähnlichen Medizinprodukten ein Bild darüber geben zu können, wie die Zulassung dieser innovativen Algorithmen aus der regulatorischen Sicht der FDA durchgeführt werden kann. Wir werden uns für diese Recherche u.a. auf folgende Quellen beziehen:
- De Novo Classification Request for IDx-DR, 12. Jänner 2018
- Correspondence Letter der FDA, 11. April 2018
- Datenbankauszug von ClinicalTrials.gov (abgerufen am 27.12.2018)
- Klinisch-wissenschaftliche Publikationen zu dem Medizinprodukt
Zusätzlich werden wir an den entsprechenden Stellen auf relevante FDA Guidance Documents verweisen. Sämtliche Dokumente werden am Ende der jeweiligen Blog-Artikel referenziert.
Zweckbestimmung - Intended Use
Bevor wir uns im Detail mit dem Zulassungsverfahren und der klinischen Validierung beschäftigen, ist es natürlich notwendig, das vorliegende Medizinprodukt zu definieren und abzugrenzen. Das IDx-DR stellt eine Diagnosesoftware dar, welches für die automatisierte Detektion des Krankheitsbild diabetische Retinopathie eingesetzt wird. Dieses mit Diabetes assozierte Krankheitsbild kann durch eine zunehmende Schädigung der Blutgefäße in der Netzhaut bis zu Erblindung führen. Eine frühzeitige Erkennung dieser minimalen Schädigungen und ein entsprechende Einleitung therapeutischer Maßnahmen ist somit wichtig für den weiteren Krankheitsverlauf. Das IDx-DR analysiert nun Fundusaufnahmen der Netzhaut, um bei PatientInnen mit Diabetes, aber ohne bisheriger Diagnosestellung der diabetischen Retinopathie die nicht-milde Form dieses augenärztlichen Krankheitsbildes zu detektieren. Die therapeutische Konsequenz ist die Überweisung an Fachambulanzen und die mögliche Initiierung der Therapie (beispielsweise der intra-vitrealen Injektion von Arzneimitteln). Zusammenfassend kann das Software-System somit als Screening-Untersuchung angesehen werden (ein Aspekt, der bei der späteren Diskussion der klinischen Endpunkte und biometrischen Planung wieder aufgegriffen wird).
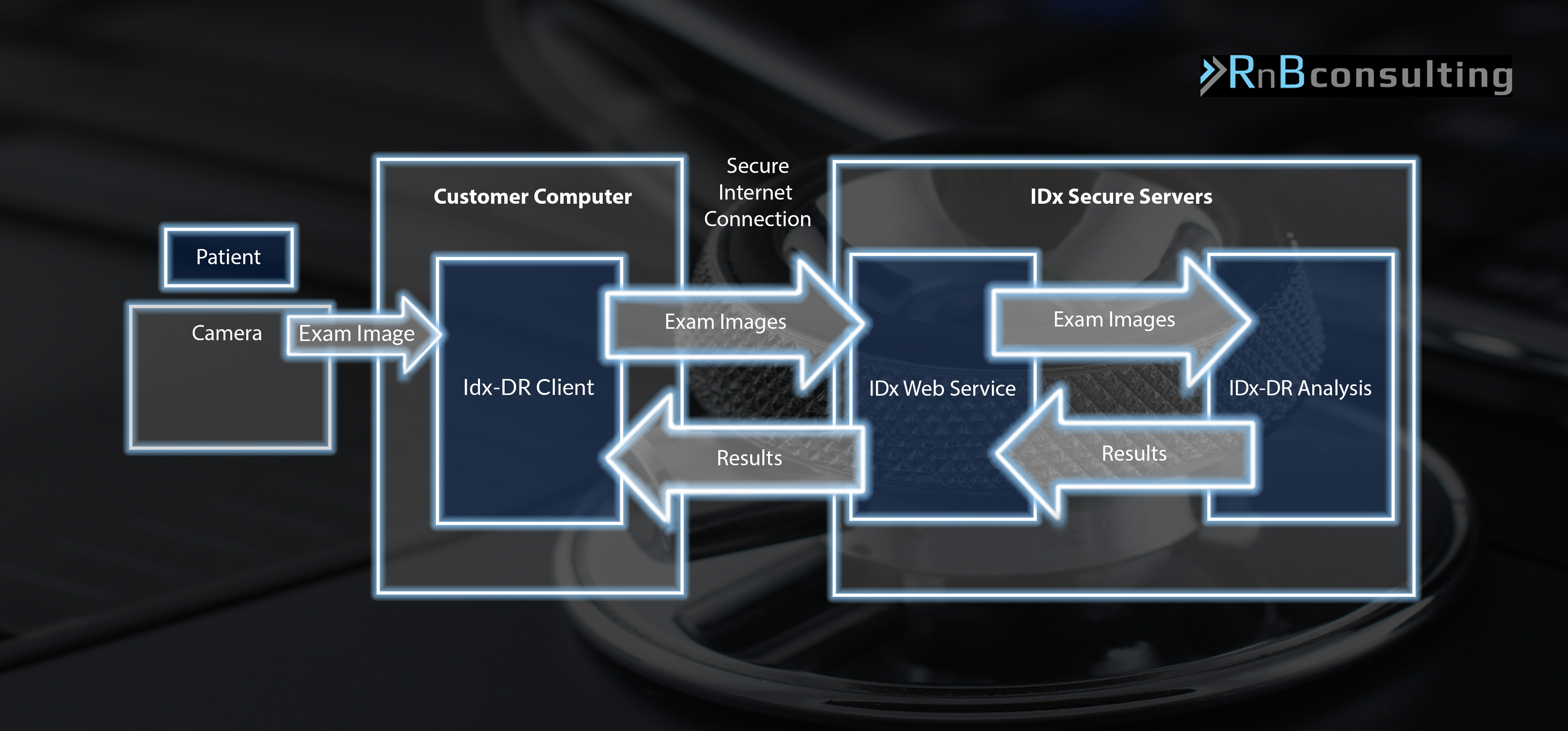
Beschreibung des Software-Systems
Die IDx-DR ist aktuell auf die gemeinsame Nutzung mit der Netzhautkamera Topcon NW400 eingeschränkt und kann in folgende Komponenten unterteilt werden:
- IDx-DR Client auf lokalen PC (Hochladen der Bilder, Empfang / Anzeige der Resultate…)
- IDx Web Service (Webserver Front-End zur Abarbeitung von Diagnoseanforderungen, Logging, Cybersecurity…)
- IDx-DR Analysis (analysiert Bilder hinsichtlich der Qualität und des Vorhandenseins von diabetischer Retinopathie)
Eine detailliertere Beschreibung der einzelnen Komponenten findet sich in dem De Novo Classification Request for IDx-DR auf den Seiten 2/3. Folgende Grafik wurde den Informationen in diesem Dokument nachgebildet.
Abgrenzung
- Die konkreten Therapieoptionen werden nicht durch die Diagnosesoftware vorgeschlagen und sollen an den entsprechenden Stellen ausschließlich dem klinischen Gesamtverständnis dienen.
- Die Netzhautkamera Topcon N400 selbst ist nicht Bestandteil des Medizinprodukts IDx-DR – wobei es natürlich Schnittstellen gibt.
Ausblick
Das Software-System wurde seitens der FDA die Kategorie Retinal diagnostic software device zugeordnet. Diese Kategorie und die entsprechende Regulation Number 21 CFR 886.1100 wurde als Ergebnis des De Novo Zulassungsprozesses neu geschaffen – näheres dazu im nächten Blog-Beitrag.
Referenzen
Homepage De Novo Classification Request for IDx-DR, 12. Jänner 2018 Correspondence Letter der FDA, 11. April 2018