Übergangsfristen der technische Dokumentation nach MDR
Was für die unterschiedlichen Risikoklassen der Medizinprodukte zu beachten ist
Die Übergangsfristen sind in Artikel 120 der MDR festgelegt – wir möchten diese für Sie zusammenfassen und visualisieren.
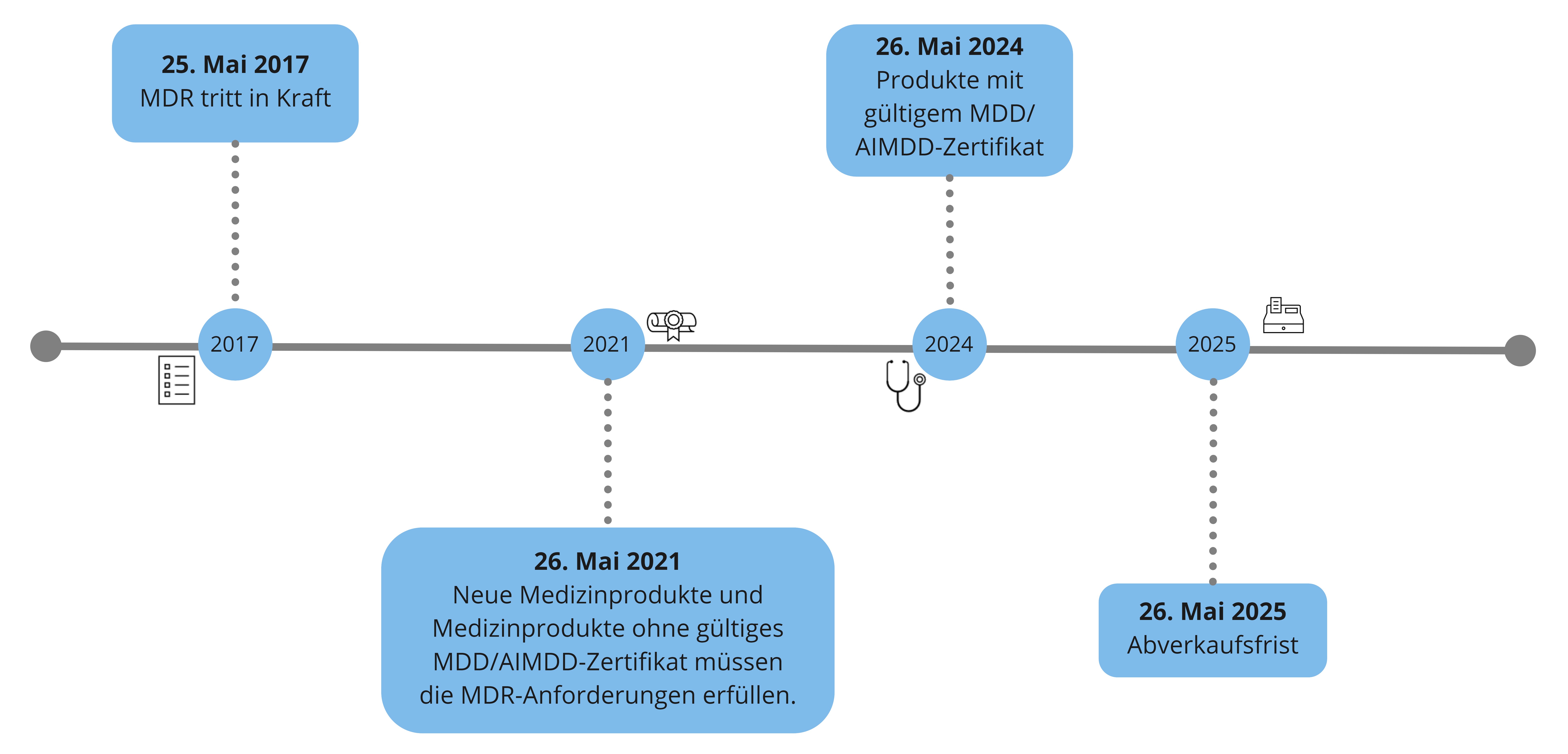
Die MDR (engl.: Medical Device Regulation) ist am 05. Mai 2017 im EU-Amtsblatt bekannt gemacht worden und am 25. Mai 2017 in Kraft getreten.
Die Übergangsfrist für die MDR war anfänglich auf 3 Jahre gesetzt worden.
Die Pandemie veranlasste die EU-Kommission dazu, diese auf 4 Jahre auszuweiten - die Verordnung (Verordnung 2020/561) dahingehend, wurde am 24. April 2020 veröffentlicht.
Medizinprodukte mit gültigem MDD/AIMDD-Zertifikat, welches vor dem 26. Mai 2021 ausgestellt wurde, gilt Art. 120, Absatz 3, welcher auf sogenannte Bestandsprodukte abzielt. Diese Produkte dürfen bis zum 26. Mai 2024 in Verkehr gebracht oder in Betrieb genommen werden. (Achtung: sofern keine wesentlichen Änderungen der Auslegung und Zweckbestimmung vorliegen!)
Bis 26. Mai 2025 ist die Bereitstellung auf dem Markt und Inbetriebnahme dieser Medizinprodukte möglich (=Abverkaufsfrist).
Hinweis: Bitte achten Sie bei Ihrem Projektmanagement bzw. der zeitlichen Planung Ihrer Zulassung, auf die derzeitige Auslastung der Benannten Stellen. Ist für Ihr Medizinprodukt eine Konformitätsbewertung durch eine Benannte Stelle notwendig, sorgen Sie frühzeitig dafür dementsprechende Angebote und Informationen hinsichtlich Auslastung einzuholen.
Welchen Einfluss hat die Risikoklasse eines Medizinproduktes auf die in Annex II und Annex III der MDR geforderten technischen Dokumentation?
Medizinprodukte sind in unterschiedliche Risikoklassen (I, Ir, Im, Is, IIa, IIb, III) einzustufen. Diese Einstufung erfolgt anhand sogenannter Klassifizierungsregeln (MDR, Annex VIII), basierend auf der vorabdefinierten Zweckbestimmung des Medizinproduktes.
Je nach Risikoklasse - haben Sie als Medizinprodukte-Hersteller – ein Konformitätsbewertungsverfahren zu wählen:
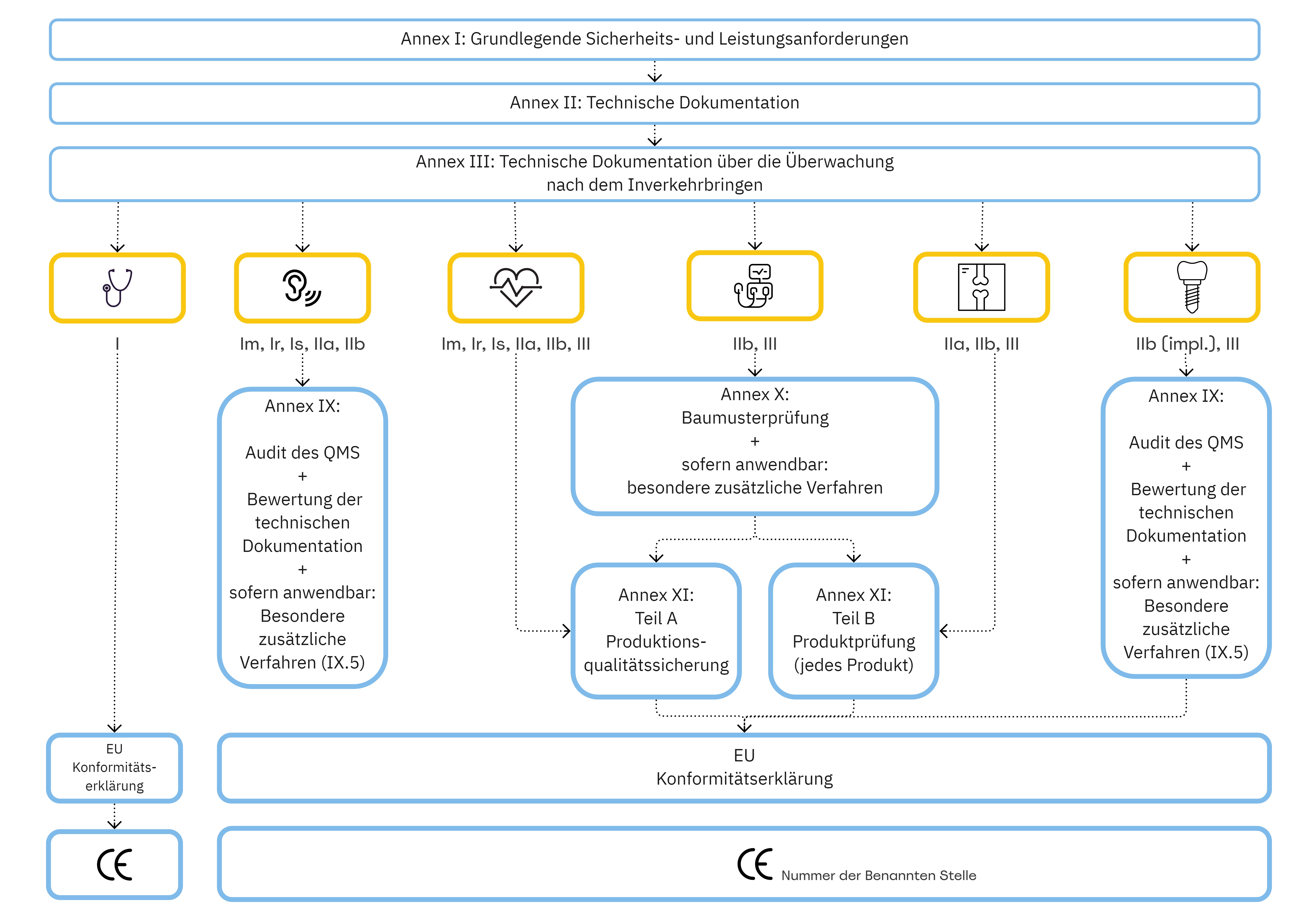
Die technische Dokumentation ist für Medizinprodukte – egal welche Risikoklasse diese aufweisen – zu erstellen. Vor allem der Nachweis der grundlegenden Sicherheits- und Leistungsanforderungen (MDR, Annex I) ist essenziell für eine erfolgreiche Zertifizierung. Der Nachweis dieses Annex I geht mit der Erstellung der technischen Dokumentation einher, da diese den dokumentierten Nachweis der Einhaltung der einzelnen Anforderungen repräsentiert.
Sie haben Fragen zu diesem Blog, anderen Themen oder zu unserem Unternehmen? Schicken Sie Ihre unverbindliche Anfrage an: office@rnb-consulting.at