Blog
EU-DSGVO – Neuerung im Bereich Datenschutz
Mit 25. Mai 2018 endet die Umsetzungsfrist für die neue Datenschutz-Grundverordnung (DSGVO) der EU, welche den Schutz natürliche Personen betreffende, personenbezogene Daten auf Grundrechtsebene verankert. In diesem Artikel wollen wir Ihnen einige der grundlegenden Inhalte der DSGVO sowie die Auswirkungen im Bereich der Medizintechnik bzw. -produkte näherbringen.
Überblick
Die neue DSGVO deckt zahlreiche Themen im Bereich IT Security, Organisation und Recht ab, wobei alle Teile einen wesentlichen Aspekt eines nachhaltigen Datenschutz-Managementsystem darstellen. Die folgenden Schwerpunkte sollten im Zuge einer erfolgreichen Umsetzung beachtet werden:
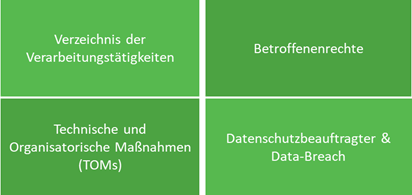
In den folgenden Abschnitten werden zwei Abschnitte der Verordnung, die einen Einfluss auf das Gesundheitswesen ausüben, näher beleuchtet.
Verarbeitung von personenbezogenen Daten
Die Verordnung definiert „Daten, aus denen die rassische und ethnische Herkunft, politische Meinungen, religiöse oder weltanschauliche Überzeugungen oder die Gewerkschaftszugehörigkeit hervorgehen, sowie die Verarbeitung von genetischen Daten, biometrischen Daten zur eindeutigen Identifizierung einer natürlichen Person, Gesundheitsdaten oder Daten zum Sexualleben oder der sexuellen Orientierung einer natürlichen Person“ (EU-DSGVO, Artikel 9 (1)) als „personenbezogene Daten besonderer Kategorie“. Die Verarbeitung solcher Daten ist grundsätzlich untersagt, außer eine der folgenden Ausnahmen ist anwendbar:
- ausdrückliche Einwilligung bzw. lebenswichtige Interessen ohne Einwilligung
- Erfordernisse aus dem Arbeitsrecht
- wenn die Daten der betroffenen Person selbst öffentlich gemacht wurden
- zur Geltendmachung von Rechtsansprüchen vor Gericht
Vor allem im Gesundheitsbereich ergeben sich dadurch zahlreiche Herausforderungen, die nur gelöst werden können, wenn alle in der Leistungserbringung beteiligte Personen und Systeme entsprechend der DSGVO operieren. Darüber hinaus ist bei der Verarbeitung von Gesundheitsdaten auf die Rechtsgrundlage dieser Verarbeitung und die Etablierung geeigneter Maßnahmen zum Schutz der Daten zu achten.
Welche Grundprinzipien dabei berücksichtigt werden können, wird im nachfolgenden Abschnitt erklärt - Privacy by Design und Privacy by Default
Privacy by Design bedeutet, dass Datenschutzvorschriften bereits bei der Entwicklung neuer Applikationen, Prozesse oder Technologien berücksichtigt werden.
- Datensparsamkeit: Ein wichtiger Aspekt der DSGVO ist die Zweckbindung der Datenerhebung, das heißt, dass nur die Daten erhoben werden dürfen, die zur Erfüllung des jeweiligen Zweckes unbedingt erforderlich sind. Um dies zu bewerkstelligen, muss die Datensparsamkeit bereits in der Applikation, Technologie sowie im entsprechenden Verarbeitungsprozess berücksichtigt werden.
- Löschfristen: Um Daten fristgerecht löschen zu können sollten die notwendigen Löschvorgänge zumindest semi- oder gänzlich automatisiert durchgeführt werden. Damit dies möglich ist, müssen gewissen Vorgänge oder Kennzeichnungen bereits beim Design des Medizinproduktes berücksichtigt werden.
- Ausübung der Betroffenenrechte: Die DSGVO verankert das Recht auf Auskunft, Richtigstellung, Widerruf, Einschränkung, Übertragbarkeit und Löschung für alle betroffenen Personen. Um diesen Rechten nachkommen zu können sollten schon in der Design-Phase des Produktes Funktionalitäten wie zum Beispiel eine Export- oder Löschfunktion berücksichtigt werden.
Unter Privacy by Default versteht man den umfassenden Schutz der Personendaten durch bereits getroffene Vor-Einstellungen. Das heißt, dass Standard-Einstellungen möglichst datenschutzfreundlich gewählt werden sollen. Ein Beispiel dazu ist das “Opt-In-Prinzip“ zur Datenerhebung. So sollte die Zustimmung zur Verarbeitung aktiv und „händisch“ durch den Betroffenen gesetzt werden und nicht vom System vorausgewählt sein. Beispiel dafür wäre das aktive Akzeptieren der Datenschutzbestimmungen bei der Absendung von Gesundheitsdaten. Zusammenfassend lässt sich sagen, dass die Verordnung einige Herausforderungen mit sich bringt, allerdings auch als Chance für einen geregelten und sicheren Datenaustausch innerhalb der EU zu sehen ist.
Gemeinsam mit unserem Kooperationspartner VACE ENGINEERING GMBH bieten wir ein mehrtägiges Praxisseminar zu diesem Thema an. Nähere Informationen zu den Inhalten und zur Anmeldung erhalten Sie unter diesem Link
Dieser Blog-Artikel wurde in Zusammenarbeit mit unserem Kooperationspartner VACE ENGINEERING GMBH verfasst. Kontaktieren Sie uns, falls sich zu diesem Thema weiterführende Fragen ergeben (office@rnb-consulting.at). Gerne unterstützen wir Sie bei der Umsetzung der EU-DSGVO im Kontext der Entwicklung von Medizinprodukten.
IVDR Teil 2 - Klassifizierung NEU
 Im zweiten Teil unserer IVDR-Blog-Reihe gehen wir näher auf das Thema der Klassifizierung von In-vitro-Diagnostika ein. Im Vordergrund steht dabei die Erläuterung des Unterschiedes zwischen dem aktuell noch geltenden Verfahren laut RL 98/79/EG – Übergangsfrist von fünf Jahren - und dem neuen risikobasierten Klassifizierungsansatz laut IVDR.
Im zweiten Teil unserer IVDR-Blog-Reihe gehen wir näher auf das Thema der Klassifizierung von In-vitro-Diagnostika ein. Im Vordergrund steht dabei die Erläuterung des Unterschiedes zwischen dem aktuell noch geltenden Verfahren laut RL 98/79/EG – Übergangsfrist von fünf Jahren - und dem neuen risikobasierten Klassifizierungsansatz laut IVDR.
Aktuelles Klassifizierungsverfahren von In-vitro-Diagnostika – RL 98/79/EG
Je nach Einsatzgebiet bzw. Zweckbestimmung des In-vitro-Diagnostikums wird dieses laut RL 98/79/EG in sogenannte Listen eingeteilt:
- Liste A „Hochrisiko Produkte“: In-vitro-Diagnostika für Blutgruppenbestimmung, HIV / Hepatitis-Tests
- Liste B „Kritische Produkte“: In-vitro-Diagnostika für Blutzuckerbestimmung (Eigenanwendung (erhöhtes Risiko aufgrund der Stechhilfe)), Trisomie21-Tests
- Eigenanwendung Bspw.: Schwangerschaftstests
- Sonstige Bspw.: Blutzuckermessgeräte (Fachpersonal)
Klassifizierung NEU – IVDR
Die für In-vitro-Diagnostika aus der RL 98/79/EG bekannte Einteilung in Listen entfällt beim neuen Klassifizierungsverfahren laut IVDR zur Gänze.
Diese Einteilung in sogenannte Listen (wie oben beschrieben) birgt – bei näherer Betrachtung – einen risikobasierten Ansatz, ist jedoch nicht mit jenem aus der IVDR zu vergleichen, da hier der Hersteller die auf sein Produkt passende Klassifizierungsregel wählen und somit seinem IVD eine Klasse zuschreiben muss. Die Klassifizierung der In-vitro-Diagnostika laut IVDR verfolgt – vergleichbar mit jenem Klassifizierungsansatz der Medizinprodukte laut RL 93/42/EWG und MDR – einen stärker risikobasierten Ansatz. Je mehr Risiko ausgehend vom IVD – im bestimmungsgemäßen Gebrauch – desto höher die Klasse. Unterteilt werden die In-vitro-Diagnostika in die Klassen A – D (A = niedrigstes Risiko / D = höchstes Risiko). Die Zuweisung der Klassen erfolgt aufgrund der Zweckbestimmung des IVDs mittels Anhang VIII der IVDR und der darin zu findenden sieben Klassifizierungsregeln.
Klassifizierungsregeln laut IVDR
Regel 1
Produkte mit den folgenden Zweckbestimmungen werden der Klasse D zugeordnet:
- Nachweis des Vorhandenseins von oder der Exposition gegenüber übertragbaren Erregern in Blut, Blutbestandteilen, Zellen, Geweben oder Organen oder in einem ihrer Derivate, um ihre Eignung für die Transfusion, Transplantation oder Zellgabe zu bewerten;
- Nachweis des Vorhandenseins von oder der Exposition gegenüber übertragbaren Erregern, die eine lebensbedrohende Krankheit mit einem hohen oder mutmaßlich hohen Verbreitungsrisiko verursachen;
- Bestimmung des Infektionsgrads einer lebensbedrohenden Krankheit, dessen Überwachung im Rahmen des Patientenmanagements von entscheidender Bedeutung ist.
Regel 2
Produkte, die zur Blutgruppenbestimmung oder Gewebetypisierung verwendet werden, um die Immunkompatibilität von für die Transfusion, Transplantation oder Zellgabe bestimmtem Blut, Blutbestandteilen, Zellen, Geweben oder Organen festzustellen, werden der Klasse C zugeordnet, es sei denn, sie werden zur Bestimmung eines der folgenden Marker eingesetzt:
- ABNull-System [A (ABO1), B (ABO2), AB (ABO3)];
- Rhesus-System [RH1 (D), RHW1, RH2 (C), RH3 (E), RH4 ©, RH5 (e)];
- Kell-System [Kel1 (K)];
- Kidd-System [JK1 (Jka), JK2 (Jkb)];
- Duffy-System [FY1 (Fya), FY2 (Fyb)].
In diesem Fall werden sie der Klasse D zugeordnet.
Regel 3
Produkte werden der Klasse C zugeordnet, wenn sie folgende Zweckbestimmung haben:
- a) Nachweis des Vorhandenseins von oder Exposition gegenüber einem sexuell übertragbaren Erreger;
- b) Nachweis eines Infektionserregers ohne hohes oder mutmaßlich hohes Verbreitungsrisiko im Liquor oder im Blut;
- c) Nachweis eines Infektionserregers, wenn ein signifikantes Risiko besteht, dass ein fehlerhaftes Ergebnis den Tod oder eine ernste gesundheitliche Schädigung der getesteten Person, des getesteten Fötus oder Embryos oder der Nachkommen der getesteten Person verursacht;
- d) Feststellung des Immunstatus von Frauen gegenüber übertragbaren Erregern zum Zwecke des pränatalen Screenings;
- e) Feststellung des Vorliegens einer Infektionskrankheit oder des Immunstatus, wenn das Risiko besteht, dass ein fehlerhaftes Ergebnis zu einer Patientenmanagemententscheidung führen würde, die eine lebensbedrohende Situation für den Patienten oder die Nachkommen des Patienten schafft;
- f) Einsatz als therapiebegleitende Diagnostika;
- g) Einsatz zur Stadieneinteilung einer Krankheit, wenn das Risiko besteht, dass ein fehlerhaftes Ergebnis zu einer Patientenmanagemententscheidung führen würde, die eine lebensbedrohende Situation für den Patienten oder die Nachkommen des Patienten schafft;
- h) Einsatz zur Krebsvorsorge, -diagnose oder -stadieneinteilung;
- i) Durchführung von Gentests beim Menschen;
- j) Überwachung des Niveaus von Arzneimitteln, Stoffen oder biologischen Komponenten, wenn das Risiko besteht, dass ein fehlerhaftes Ergebnis zu einer Patientenmanagemententscheidung führen würde, die eine lebensbedrohende Situation für den Patienten oder die Nachkommen des Patienten schafft;
- k) Management von Patienten, die an einer lebensbedrohenden Krankheit leiden oder deren Zustand lebensbedrohend ist;
- l) Untersuchung auf genetisch bedingte Störungen beim Embryo oder Fötus;
- m) Untersuchung auf genetisch bedingte Störungen bei Neugeborenen, wenn der fehlende Nachweis und die fehlende Behandlung dieser Störungen zu lebensbedrohenden Situationen oder ernsten gesundheitlichen Schädigungen führen können.
Regel 4
- a) Produkte zur Eigenanwendung werden der Klasse C zugeordnet, ausgenommen Produkte zur Feststellung einer Schwangerschaft, zur Fertilitätsuntersuchung und zur Bestimmung des Cholesterinspiegels und Produkte zum Nachweis von Glukose, Erythrozyten, Leukozyten und Bakterien im Urin, die der Klasse B zugeordnet werden.
- b) Produkte zur Verwendung in patientennahen Tests werden für sich allein klassifiziert.
Regel 5
Die folgenden Produkte werden der Klasse A zugeordnet:
- a) Erzeugnisse für den allgemeinen Laborbedarf, Zubehör ohne kritische Merkmale, Pufferlösungen, Waschlösungen sowie allgemeine Nährmedien und histologische Färbungen, die vom Hersteller dafür vorgesehen sind, die Produkte für In-vitro-Diagnoseverfahren im Zusammenhang mit einer spezifischen Untersuchung einsetzbar zu machen;
- b) Instrumente, die vom Hersteller speziell für die Verwendung bei In-vitro-Diagnoseverfahren vorgesehen sind;
- c) Probenbehältnisse.
Regel 6 Produkte, die nicht unter die zuvor beschriebenen Klassifizierungsregeln fallen, werden der Klasse B zugeordnet.
Regel 7 Produkte, bei denen es sich um Kontrollgeräte ohne einen zugewiesenen quantitativen oder qualitativen Wert handelt, werden der Klasse B zugeordnet.
Für IVD-Hersteller und auch zuständige benannte Stellen ergeben sich aufgrund des neuen Klassifizierungsverfahrens neue Herausforderungen, da dieses eine Änderung des Konformitätsbewertungsverfahrens bedeuten kann. Vor allem der klarer definierte risikobasierte Klassifizierungsansatz lässt erkennen, dass der Fokus nun stärker auf dem individuellen klinischen Kontext des IVDs liegt.
IVDR Teil 1 - Definition In-vitro-Diagnostikum
Parallel zu unserer MDR-Blogreihe möchten wir nun auch eine IVDR-Blogreihe starten, um auf die wesentlichen Neuerungen - Vergleich RL 98/79/EG & IVDR - aufmerksam zu machen.
Definition IVD
Ein In-Vitro-Diagnostikum ist per se als Medizinprodukt zu definieren & zu verstehen!

Definition laut IVDR Artikel 2 (2): “In-vitro-Diagnostikum” bezeichnet ein Medizinprodukt, das als Reagenz, Reagenzprodukt, Kalibrator, Kontrollmaterial, Kit, Instrument, Apparat, Gerät, Software oder System – einzeln oder in Verbindung miteinander – vom Hersteller zur In-vitro-Untersuchung von aus dem menschlichen Körper stammenden Proben, einschließlich Blut- und Gewebespenden, bestimmt ist und ausschließlich oder hauptsächlich dazu dient, Informationen zu einem oder mehreren der folgenden Punkte zu liefern:
- über physiologische oder pathologische Prozesse oder Zustände,
- über kongenitale körperliche oder geistige Beeinträchtigungen,
- über die Prädisposition für einen bestimmten gesundheitlichen Zustand oder eine bestimmte Krankheit,
- zur Feststellung der Unbedenklichkeit und Verträglichkeit bei den potenziellen Empfängern,
- über die voraussichtliche Wirkung einer Behandlung oder die voraussichtlichen Reaktionen darauf oder
- zur Festlegung oder Überwachung therapeutischer Maßnahmen.
Probenbehältnisse gelten als auch In-vitro-Diagnostika;
Definition laut RL98/79/EG Artikel 1 (2) (b): „In-vitro-Diagnostikum“ jedes Medizinprodukt, das als Reagenz, Reagenzprodukt, Kalibriermaterial, Kontrollmaterial, Kit, Instrument, Apparat, Gerät oder System — einzeln oder in Verbindung miteinander — nach der vom Hersteller festgelegten Zweckbestimmung zur In-vitro-Untersuchung von aus dem menschlichen Körper stammenden Proben, einschließlich Blut- und Gewebespenden, verwendet wird und ausschließlich oder hauptsächlich dazu dient, Informationen zu liefern
- über physiologische oder pathologische Zustände oder
- über angeborene Anomalien oder
- zur Prüfung auf Unbedenklichkeit und Verträglichkeit bei den potentiellen Empfängern oder
- zur Überwachung therapeutischer Maßnahmen.
Probenbehältnisse gelten als In-vitro-Diagnostika. Probenbehältnisse sind luftleere wie auch sonstige Medizinprodukte, die von ihrem Hersteller speziell dafür gefertigt werden, aus dem menschlichen Körper stammende Proben unmittelbar nach ihrer Entnahme aufzunehmen und im Hinblick auf eine In-vitro-Diagnose aufzubewahren. Erzeugnisse für den allgemeinen Laborbedarf gelten nicht als In- Vitro-Diagnostika, es sei denn, sie sind aufgrund ihrer Merkmale nach ihrer vom Hersteller festgelegten Zweckbestimmung speziell für In-vitro-Untersuchungen zu verwenden;
Neuerungen
Im Vergleich zur akutell noch - Übergangsfrist von fünf Jahren - geltenden IVD-Richtlinie RL 98/79/EG ergeben sich aufgrund der Definition der In-vitro-Diagnostika laut IVDR nennenswerte Neuerungen:
- Software ist nun explizit in der Begriffsbestimmung erwähnt.
- Die IVDR stellt klar, dass auch das Liefern von Informationen hinsichtlich “Anfälligkeit” gewisser Krankheitsbilder aufgrund genetischer Konstellationen mit aufgenommen wird. Dieser Punkt wird voraussichtlich vor allem für die Leistungsbewertung ein große Herausforderung werden.
- Auch das Überbringen von Informationen gewisser Wahscheinlichkeiten bzgl. der voraussichtlichen Wirkung einer Behandlung oder die voraussichtlichen Reaktionen darauf fallen - laut IVDR - nun explizit in die Zweckbestimmung eines In-vitro-Diagnostikums. Es ist unumstritten, dass dies auch bereits im Zuge der RL 98/79/EG der Fall ist, nur wird die Analyse ggf. auftretender Nebenwirkungen in der IVDR nun explizit in die Definition eines In-vitro-Diagnostikums aufgenommen.
Auffällig ist, dass die Definition eines IVDs laut IVDR im Vergleich zur RL 98/79/EG weitaus detaillierter dargestellt wird.
Erfahren Sie im zweiten Teil unserer IVDR-Blogreihe, welche Neuerungen hinsichtlich Klassifzierung von In-vitro-Diagnostika auf IVD-Hersteller zukommen werden.
Verschuldensunabhängige Gefährdungshaftung für fehlerhafte Produkte
Das rechtliche Rahmenwerk betreffend Medizinprodukte zielt darauf ab, dass Medizinprodukte für Patienten, Anwender und Dritte sicher und zugleich wirksam sind. Diese Zielsetzung wird grundsätzlich durch die Einhaltung der grundlegenden Anforderungen (z.B. RL 93/42 EWG – "Der Weg zum Medizinprodukt - Teil 5" Konformitätsbewertungsverfahren für allgemeine Medizinprodukte) gewährleistet. Trotz aller Sorgfalt in der Entwicklung und der Produktion kann es jedoch vorkommen, dass ein einzelnes Stück eines Produktes fehlerhaft ist, auch dann, wenn der Hersteller “alles richtiggemacht hat”. Wie die Rechtslage in diesem Fall aussieht, lesen Sie im folgenden Fachbeitrag.
1. Rechtslage
Das auf EU-Richtlinien zurückgehende österreichische Produkthaftungsgesetz1 (im folgenden kurz PHG genannt) normiert eine verschuldensunabhängige Gefährdungshaftung für Personen- und Sachschäden, wenn durch den Fehler eines Produkts ein Mensch getötet, am Körper verletzt oder an der Gesundheit geschädigt oder eine von dem Produkt verschiedene körperliche Sache beschädigt wird. Der Europäische Gerichtshof (im folgenden kurz EuGH genannt) begründet die verschuldensunabhängige Haftung des Herstellers damit, dass nur mit dieser „das unserem Zeitalter fortschreitender Technisierung eigene Problem einer gerechten Zuweisung der mit der modernen technischen Produktion verbundenen Risiken in sachgerechter Weise gelöst werden“ könne. Als Produkt im Sinne des PHG wird jede bewegliche körperliche Sache, auch wenn sie ein Teil einer anderen beweglichen Sache oder mit einer unbeweglichen Sache verbunden worden ist, einschließlich Energie, definiert. Fehlerhaft ist ein Produkt, wenn es nicht die Sicherheit bietet, die man unter Berücksichtigung aller Umstände zu erwarten berechtigt ist. Der Fehler selbst kann auf einen Konstruktions-, Produktions- oder Instruktionsfehler beruhen. Für den Ersatz von Schäden im Sinne des PHG haftet der Unternehmer, der es hergestellt und in den Verkehr gebracht hat und der Unternehmer, der es zum Vertrieb in den Europäischen Wirtschaftsraum eingeführt und hier in den Verkehr gebracht hat (Importeur). Kann der Hersteller oder der Importeur nicht festgestellt werden, so haftet jeder Unternehmer, der das Produkt in den Verkehr gebracht hat, wenn er nicht dem Geschädigten in angemessener Frist den Hersteller beziehungsweise den Importeur oder denjenigen nennt, der ihm das Produkt geliefert hat. Bei Sachschäden (also Schäden, die durch das Produkt an anderen Sachen entstehen) besteht nur dann eine Haftung, wenn den Schaden nicht ein Unternehmer erlitten hat, der die Sache überwiegend in seinem Unternehmen verwendet hat, und überdies nur mit dem € 500,00 übersteigenden Teil. Die Haftung kann gemäß § 8 PHG jedoch durch den Nachweis ausgeschlossen werden, dass
- der Fehler auf eine Rechtsvorschrift oder behördliche Anordnung zurückzuführen ist, der das Produkt zu entsprechen hatte,
- die Eigenschaften des Produkts nach dem Stand der Wissenschaft und Technik zu dem Zeitpunkt, zu dem es der in Anspruch Genommene in den Verkehr gebracht hat, nicht als Fehler erkannt werden konnten oder
- (wenn der in Anspruch Genommene nur einen Grundstoff oder ein Teilprodukt hergestellt hat) der Fehler durch die Konstruktion des Produkts, in welches der Grundstoff oder das Teilprodukt eingearbeitet worden ist, oder durch die Anleitungen des Herstellers dieses Produkts verursacht worden ist.
Hat ein Ersatzpflichtiger Schadenersatz geleistet und ist der Fehler des Produkts weder von ihm noch von einem seiner Leute verursacht worden, so kann er vom Hersteller des fehlerhaften Endprodukts, Grundstoffs oder Teilprodukts Rückersatz verlangen.
2. Haftung bei fehlerhaften Medizinprodukten
Laut EuGH sind bei medizinischen Geräten die Anforderungen an die Sicherheit, die die Patienten zu erwarten berechtigt sind, in Anbetracht ihrer Funktion und der Situation besonderer Verletzlichkeit der diese Geräte nutzenden Patienten, besonders hoch. Ein Medizinprodukt kann nach der Rechtsprechung des EuGH auch dann als fehlerhaft qualifiziert werden, wenn eine potentielle Fehlerhaftigkeit der Produktgruppe oder -serie, der es angehört, festgestellt wurde. Ein Fehler des konkreten Produkts muss in diesem Fall laut einer Entscheidung des EuGH nicht vorliegen (vgl. EuGH3 zu C-503/13) ). In dieser Entscheidung hatte der Hersteller mitgeteilt, dass ein zur hermetischen Versiegelung der von ihm vertriebenen Herzschrittmachern verwendetes Bauteil möglicherweise einem sukzessiven Verfall unterliege und dies zur vorzeitigen Batterieerschöpfung mit Verlust der Telemetrie und/oder der Herzstimulationstherapie ohne Vorwarnung führen könne.2 Der Schadenersatz umfasst in solchen Fällen im Übrigen alles, was erforderlich ist, um die Schadensfolgen zu beseitigen und das Sicherheitsniveau wiederherzustellen, das man im Sinne der gegenständlichen EU-Richtlinie zu erwarten berechtigt ist. Bei dem durch eine chirurgische Operation zum Austausch eines fehlerhaften Produkts verursachten Schaden haftet der Hersteller, wenn diese Operation erforderlich ist, um den Fehler des betreffenden Produkts zu beseitigen.
Fazit
Gerade bei Produkten der Medizintechnik kann eine Haftung nach dem PHG zu weitreichenden finanziellen Folgen führen. Je nach Produkt ist der Schaden unterschiedlich und mit einer zumeist geringen Wahrscheinlichkeit behaftet, wenn Sie im Entwicklungs- und Herstellungsprozess die wesentlichen Vorgaben erfüllt haben. Ganz ausschließen können Sie eine möglich Haftung nach PHG aber leider nicht.
Das gesamte RnB-Team bedankt sich herzlich bei Dr. Stefan Lahnsteiner für die Erstellung dieses Blog-Artikels!
MDR Teil 6 - Konformitätsbewertungsverfahren
Der sechste Teil unserer MDR-Blog-Artikel-Reihe beschäftigt sich mit den durch die MDR geforderten Konformitätsbewertungsverfahren. Wie bereits aus der RL 93/42/EWG bekannt, stellt auch die MDR - je nach Risikoklasse des Medizinproduktes - unterschiedliche wählbare Wege des Konformitätsbewertungsverfahrens zur Verfügung.
Überblick - Forderung der MDR
Bevor ein Hersteller sein Produkt in Verkehr bringt, muss eine Bewertung der Konformität des betreffenden Produktes in Anlehnung an die in den Anhängen IX - XI zu findenden Konformitätsbewertungsverfahren durchgeführt werden. Wie auch bereits aus der RL 93/42/EWG bekannt, hängt die Wahl des Konformitätsbewertungsfahrens von der Risikoklasse des Medizinproduktes ab:
- I
- Im (Medizinprodukte mit Messfunktion)
- Is (Sterile Medizinprodukte)
- Iwci (Wiederverwendbare chirurgische Medizinprodukte - Abkürzung (Iwci) in MDR nicht definiert)
- IIa
- IIb
- III
Ziel der Konformitätsbewertung ist die Erbringung des Nachweises, dass das Medizinprodukt die Sicherheits- und Leistungsanforderungen der MDR aus Anhang I auch tatsächlich erfüllt. Im Vergleich dazu bedeutet die Konformitätsbewertung auf Basis der RL 93/42/EWG die Erbringung des Nachweises, dass die grundlegnden Anforderungen aus Anhang I erfüllt sind.
Der Weg zur CE-Kennzeichnung

Erläuterung der zu wählenden Konformitätsbewertungsverfahren pro Risikoklasse
(ausgenommen Sonderanfertigungen & Prüfprodukte)
Produkte der Klasse III - Konformitätsbewertungsverfahren gemäß Anhang IX “Konformitätsbewertung QMS und Technische Dokumentation”. Alternativ kann das Konformitätsbewertungsverfahren gemäß Anhang X “Baumusterprüfung” in Kombination mit Anhang XI “Produktkonformitätsprüfung” gewählt werden.

Produkte der Klasse IIb - Konformitätsbewertungsverfahren gemäß Anhang IX “Konformitätsbewertung QMS und Technische Dokumenation” Kapitel I (QMS) und III (Verwaltungsbestimmungen) , sowie der Bewertung der technischen Dokumentation gemäß Abschnitt 4 des Anhang IX für zumindest eines repräsentativen Produktes pro generischer Produktgruppe.
Produkte der Klasse IIb - Für implantierbare Produkte der Klasse IIb wird die Bewertung der technischen Dokumentation nach Anhang IX Abschnitt 4 jedoch für jedes Produkt vorgenommen. (ausgenommen: Nahtmaterial, Klammern, Zahnfüllungen, Zahnspangen, Zahnkronen, Schrauben, Keile, Zahn- bzw. Knochenplatten, Drähte, Stifte und Verbindungsstücke) Alternativ kann das Konformitätsbewertungsverfahren nach Anhang X “Baumusterprüfung” in Kombination mit dem Konformitätsbewertungsverfahren nach Anhang XI “Produktkonformitätsprüfung” gewählt werden.

Produkte der Klasse IIa - Konformitätsbewertungsverfahren gemäß Anhang IX “Konformitätsbewertung QMS und Technische Dokumentation” Kapitel I (QMS) und III inkl. einer Bewertung der technischen Dokumentation gemäß Abschnitt 4 des Anhang IX für zumindest eines repräsentativen Produktes pro generischer Produktgruppe. Alternativ kann die auf Grundlage von Anhang II und Anhang III erstellte technische Dokumentation durch Abschnitt 10 oder Abschnitt 18 des Anhanges XI bewertet werden.

Produkte der Klasse I - Für reine Klasse I Medizinprodukte stellt der Hersteller selbst die EU-Konformitätserklärung aus (Artikel 19). Bei Produkten mit Messfunktion, sterilen Produkten oder bei wiederverwendbaren chirurgischen Produkten benötigt der Hersteller für die 
Sonderanfertigungen - Bei Sonderanfertigungen ist das Konformitätsbewertungsverfahren gemäß Anhang XIII zu wählen.
QMS für alle
Im Zuge der Betrachtung der aus der MDR geforderten Konformitätsbewertungsverfahren ist besonders das Qualitätsmanagement hervorzuheben. Die MDR fordert von allen Herstellern - Risikoklasse I-III - das Definieren, Dokumentieren und vor allem “Leben” eines QM-Systems.
<< Newer entries | Older entries >>