Blog
„Stheno v1.0“ erfolgreich fertiggestellt
Nach rund zwei Jahren ist es so weit: Das Konsortium des Forschungsprojekts „Medical EDUcation in Surgical Aneurysm clipping (MEDUSA)“ hat den ersten Prototyp „Stheno v1.0“ erfolgreich fertiggestellt.
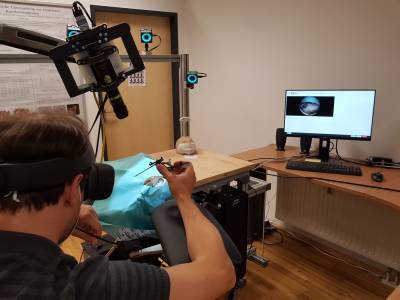 Das Gehirn ist das komplexeste menschliche Organ, dessen krankheitsbedingte Beschädigung schwerwiegende Folgen für Patient*innen hat. Die operative Behandlung neurologischer Krankheiten, wie Gehirnblutungen, ist jedoch äußerst schwierig, da Zielareale oft in hochfunktionalen und vielschichtigen Gewebestrukturen eingebettet sind. Nur durch Hochtechnologie und außergewöhnliche kognitive und motorische Fähigkeiten von Neurochirurg*innen werden erfolgreiche Eingriffe möglich. Die Stärkung beider Komponenten steht im Zentrum des Forschungsprojekts MEDUSA. Komplexe medizinische Eingriffe qualitativ und quantitativ in einer realistischen Umgebung zu simulieren, erzeugt optimale Trainings- und Ausbildungsmöglichkeiten, welche die Patient*innensicherheit steigern.
Das Gehirn ist das komplexeste menschliche Organ, dessen krankheitsbedingte Beschädigung schwerwiegende Folgen für Patient*innen hat. Die operative Behandlung neurologischer Krankheiten, wie Gehirnblutungen, ist jedoch äußerst schwierig, da Zielareale oft in hochfunktionalen und vielschichtigen Gewebestrukturen eingebettet sind. Nur durch Hochtechnologie und außergewöhnliche kognitive und motorische Fähigkeiten von Neurochirurg*innen werden erfolgreiche Eingriffe möglich. Die Stärkung beider Komponenten steht im Zentrum des Forschungsprojekts MEDUSA. Komplexe medizinische Eingriffe qualitativ und quantitativ in einer realistischen Umgebung zu simulieren, erzeugt optimale Trainings- und Ausbildungsmöglichkeiten, welche die Patient*innensicherheit steigern.
Ausblick auf die weiteren Forschungs- und Entwicklungsaktivitäten
Auf Basis des ersten Prototyps „Stheno v1.0“ wird in der zweiten Projekthälfte an der Entwicklung von „Euryale v2.0“ sowie schließlich an der finalen Version „Medusa v3.0“ motiviert weitergearbeitet. Letztere umfasst auch das Modul „tomorrow’s patient“: Durch den Import personenbezogener Patient*innendaten und die individuelle präoperative Planung können sich Neurochirurg*innen bestmöglich auf eine patient*innenbezogene Aneurysma-Clipping-Operation vorbereiten. So können komplexe Fälle in einer simulierten Umgebung bereits im Vorhinein gefahrlos trainiert werden. Die Entwicklung eines professionellen Didaktik-Konzeptes und GUI-Designs, die holografische Darstellung mittels Mixed-Reality-Brillen sowie die durch Neurochirurg*innen des Kepler Universitätsklinikums unterstützte Evaluierung und Validierung des Simulators stellen weitere wichtige Schritte im Rahmen der Vorbereitung für die Anwendung am Menschen dar.
Wir als RnB-Consulting GmbH freuen uns, Teil eines so spannenden Projektes sein zu dürfen und freuen uns auf die weiteren Enticklungsschritte der kommenden Monate.
Bleiben Sie up2date auf unserer MEDUSA-Homepage! https://medusa.health/de
Usability von IVDs
Sie sind Hersteller von In vitro Diagnostika und haben sich bis dato wenig bis kaum mit dem Thema Usability Engineering auseinandergesetzt?
 Wir empfehlen: Da der Geltungsbeginn der IVDR immer näher rückt, sich bereits auch schon jetzt Gedanken über die Analyse der Gebrauchstauglichkeit zu machen.
Wir empfehlen: Da der Geltungsbeginn der IVDR immer näher rückt, sich bereits auch schon jetzt Gedanken über die Analyse der Gebrauchstauglichkeit zu machen.
Die IVDR fordert diese Betrachtung und Dokumentation der Gebrauchstauglichkeit in ihrem Annex I und den darin zu findenden grundlegenden Sicherheits- und Leistungsanforderungen.
Die Sicherheit ausgehend von der Anwendung Ihres Produktes ist essenziell. Mit dem kommenden Geltungsbeginn der IVDR finden sich in Annex I Anforderungen, die exakt die Themen Ergonomie und vor allem die Spezifikation Ihrer Anwender (User) fordert. So müssen Sie bspw. darauf achten, dass Anwenderfehler ausgeschlossen oder – sofern nicht anders möglich – verringert werden, indem Sie entwicklungsbegleitend die Ergonomie des Produktes und das Know-How Ihrer Anwender genauestens definieren, analysieren, dokumentieren und mittels Evaluierungen auch klar und rückverfolgbar (Stichwort: Risikomanagement) nachweisen können.
Sollten Sie Fragen zum Aufbau eines der Verordnung gerecht werdenden Dokumentation hinsichtlich Usability Engineering & Risikomanagement haben, können Sie sich jeder Zeit gerne an uns wenden!
Künstliche Intelligenz in der Medizin
Fluch und Segen zugleich
„Ich fürchte mich vor dem Tag, an dem die Technologie unsere Menschlichkeit übertrifft.“ -
Albert Einstein
Der rasant wachsende Innovationsgrad der Medizintechnik und die sich daraus ergebenden Einsatzmöglichkeiten innerhalb der medizinischen Versorgung bringen neben dementsprechenden neuen Erkenntnissen und - in spezifischen Feldern – kontinuierlichen Prozessverbesserungen und Arbeitserleichterungen, leider auch bis dato unbekannte Fehlerquellen und Hürden mit sich.
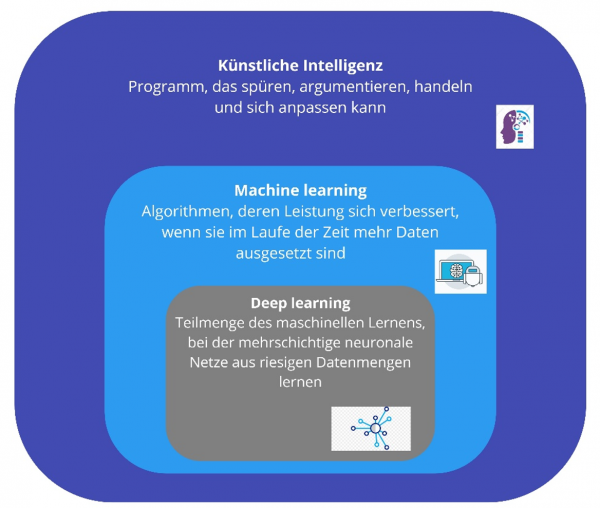
Was ist nun eigentlich der Unterschied zwischen „machine learning“ und „artificial intelligence“ ? Gibt es überhaupt einen? JA!
„Machine Learning“ ist eine Anwendung der künstlichen Intelligenz (KI), die Systemen die Möglichkeit bietet, automatisch aus Erfahrungen zu lernen und sich zu verbessern, ohne explizit programmiert zu werden.
„Machine Learning“ konzentriert sich auf die Entwicklung von Computerprogrammen, die auf Daten zugreifen und diese lernen können. Deep Learning ist eine Teilmenge des maschinellen Lernens in der künstlichen Intelligenz (KI), die über Netzwerke verfügt, die in der Lage sind, unbeaufsichtigt aus unstrukturierten oder nicht gekennzeichneten Daten zu lernen. Auch bekannt als Deep Neural Learning oder Deep Neural Network.
Vor allem die Fähigkeit, menschliches Verhalten und die menschliche Entscheidungsfähigkeit zu simulieren, zeichnet die künstliche Intelligenz von heute aus.
Doch was passiert, wenn aufgrund von Fehlinterpretationen Behandlungsfehler resultieren? Wer kann und wird dabei zur Verantwortung gezogen?
Die Zulassung von Medizinprodukten ist klar geregelt und unterliegt einem strikten regulatorischen Rahmenwerk.
Auch Software kann sich – aufgrund seines bestimmungsgemäßen Einsatzes – als Medizinprodukt qualifizieren und hat demnach die zutreffenden regulatorischen Anforderungen zu erfüllen.
Eine maßgebliche – regulatorische – Lücke tut sich bei den sicherheitsrelevanten Anforderungen an AI-gestützte Medizinprodukte bzw. Software auf.
Genau aus diesem Grund wurde eine IMDRF-Arbeitsgruppe ins Leben gerufen (IMDRF = International Medical Device Regulators Forum).
Diese beschäftigt sich aktuell mit der Ausarbeitung eines Leitfadens über die regulatorischen Anforderungen des Einsatzes künstlicher Intelligenz im medizinischen Bereich.
Primäres Ziel ist die Schaffung eines einheitlichen Sicherheits- und Schutzniveaus dieses technologischen Fortschrittes.
Mit Hilfe des nachstehenden Links bekommen Sie einen Einblick in den aktuellen Status und in die weiteren Vorhaben der IMDRF-Arbeitsgruppe.
IMDRF Artificial Intelligence Medical Devices
Die Aufgaben des Expertengremiums
 Für die effiziente Umsetzung der MDR und IVDR werden Expertengremien, Fachlaboratorien und EU-Referenzlaboratorien eingerichtet.
Für die effiziente Umsetzung der MDR und IVDR werden Expertengremien, Fachlaboratorien und EU-Referenzlaboratorien eingerichtet.
Bei den Mitgliedern des Expertengremiums handelt es sich um hochkarätige Experten auf ihrem Gebiet, die von der Europäischen Kommission nach einem Aufruf zur Interessenbekundung ernannt werden. Die Auswahl erfolgt durch die Europäische Kommission und die Ernennung in Absprache mit der Koordinierungsgruppe Medizinprodukte. Die Anzahl der Mitglieder der einzelnen Gremien wird von der Kommission nach Maßgabe der jeweiligen Erfordernisse festgelegt.
Die Aufgaben des Expertengremiums bestehen darin, die Europäische Kommission, die Mitgliedstaaten, die benannten Stellen und die Hersteller wissenschaftlich und technisch zu beraten, zu Leitlinien und anderen Dokumenten beizutragen und neu auftretende Probleme zu behandeln.
Die Expertengremien haben je nach Bedarf folgende Aufgaben:
- Abgabe einer Stellungnahme zu den klinischen Bewertungen der benannten Stellen bestimmter Hochrisiko-Medizinprodukte und zur Leistungsbewertung bestimmter In-vitro-Diagnostika
- Beratung der Koordinierungsgruppe Medizinprodukte (MDCG) und der Europäischen Kommission hinsichtlich Fragen zur Sicherheit und Leistung von Medizinprodukten und In-vitro-Diagnostika
- Beratung von Herstellern zu ihrer klinischen Entwicklungsstrategie und zu Vorschlägen für klinische Prüfungen
- Beratung von EU-Ländern, Herstellern und benannten Stellen in verschiedenen wissenschaftlichen und technischen Fragen
- Unordered List ItemMitwirkung an der Entwicklung und Pflege der einschlägigen Leitfäden, Gemeinsame Spezifikationen und internationalen Normen
- Abgabe von Stellungnahmen zu Konsultationen von Herstellern, EU-Ländern und benannten Stellen
Die Experten werden für einen Zeitraum von drei Jahren ernannt, wobei eine Verlängerung möglich ist. Während dieser Zeit gehören sie einem der 12 Gremien an (ua. Neurologie, Medizinische In-vitro Diagnostika, Rehabilitation…).
Das erste wissenschaftliche Gremium, das eingerichtet werden soll, sind die Expertengremien; die Referenzlaboratorien und Fachlaboratorien werden zu einem späteren Zeitpunkt eingerichtet.
Weiters stellt die Europäische Kommission ein Sekretariat für die Expertengremien zur Verfügung, um die Arbeit der Expertengremien zu unterstützen.
Zu den Aufgaben des Sekretariats gehören:
- die Ermittlung und Bewältigung potenzieller Interessenkonflikte,
- die Überwachung der Arbeit,
- die Kontrolle der Einhaltung der Geschäftsordnung und
- die Veröffentlichung von Stellungnahmen, Ansichten und Positionen
Nähere Information finden Sie unter: Expert Panels
RnB-Consulting unterstützt Sie im Rahmen der Implementierung der europäischen Verordnungen für Medizinprodukte und In vitro Diagnostika (MDR und IVDR) und steht dabei mit erfahrenen Experten zur Seite.
Meilensteine VOR Markteinführung
 Sie haben eine innovative Idee bzgl. eines Produktes und wollen dieses ehestmöglich Inverkehrbringen?
Sie haben eine innovative Idee bzgl. eines Produktes und wollen dieses ehestmöglich Inverkehrbringen?
Am allerwichtigsten ist, dass Sie sich vergewissern, ob sich Ihr Produkt als sogenanntes Medizinprodukt qualifiziert oder nicht. Um diese Qualifikation nachweisen zu können, ist es essenziell, die Zweckbestimmung Ihres Produktes zu verfassen.
Die in der Verordnung ( MDR) zu findenden Definition eines Medizinproduktes kann Ihnen bei dieser Abgrenzungsthematik – „Medizinprodukt JA/NEIN“ sicherlich behilflich sein.
Sofern Ihr Produkt sich als Medizinprodukt qualifiziert, sind Sie als gesetzlicher Hersteller verpflichtet, das für Sie und Ihr Produkt geltende regulatorische Rahmenwerk zu identifizieren, einzuhalten und dementsprechend nachzuweisen.
Sie haben Fragen zu den initial wichtigsten Schritten?
Kontaktieren Sie uns und holen Sie sich im Idealfall auch alle wichtigen Infos aus dem aktuellen Buch:
Medizinprodukte und IVD: Fit für Europa

<< Newer entries | Older entries >>